- ¿Qué es un tejido?.
- Haz un esquema con la clasificación de los tejidos.
- ¿Como está constituido el tejido epiterial?
- Existen dos tipos de tejido epiterial ¿en que se diferencian?.
- ¿Es lo mismo una glándula exocrina que una endocrina?¿En que se diferencian?. Dibujalo.
- Haz un dibujo del tejido conjuntivo nombrando sus partes y explicando de que está formado.
- ¿Que es el tejido adiposo?.
- Enumera las diferencias entre el tejido muscular liso y estriado esquelético.
- Dibuja una neurona indicando sus partes.
- ¿Cual es la función de las células gliales?.
- ¿Que es un órgano? Pon un ejemplo indicando los tejidos que lo forman.
- Explica la diferencia entre aparato y sistema, poniendo un ejemplo.
martes, 6 de octubre de 2009
Anatomia 6 octubre 09
Ejercicios tema 2:
Dia 6 de octubre 09
Dia 6 de octubre 09.
1º hora AGC, elijieron delegada a ana cordoba y subdelegado.
2º hora ES estudio del sector, repasamos los sectores, y mando nuevas fotocopias.
3º hora HD, se entregaron los resumenes, se promovio buscar en el diccionario,esterilización, desinfección y desinfectacion. dimos tema. Examen manicura posiblemente el jueves 15
4º y 5º hora. Cosmetologia, mas formulación, puesta de examen , miercoles 14 examen química. Mando ejercicios de tablas, de algunos elementos, del grupo 1 y del periodo 2.
6º hora. Anatomia. Dimos el tejido nervioso y 12 ejercicios del cuadernillo, tema 2.
1º hora AGC, elijieron delegada a ana cordoba y subdelegado.
2º hora ES estudio del sector, repasamos los sectores, y mando nuevas fotocopias.
3º hora HD, se entregaron los resumenes, se promovio buscar en el diccionario,esterilización, desinfección y desinfectacion. dimos tema. Examen manicura posiblemente el jueves 15
4º y 5º hora. Cosmetologia, mas formulación, puesta de examen , miercoles 14 examen química. Mando ejercicios de tablas, de algunos elementos, del grupo 1 y del periodo 2.
6º hora. Anatomia. Dimos el tejido nervioso y 12 ejercicios del cuadernillo, tema 2.
Dia 5 Octubre 09
Dia 5 octubre 09.
1º, 2º y 3º hora. Corte de cabello. Teoria libro, hacer fichas. Viernes materiales
4º y 5º hora. Cambio de forma. Muñeca termine la 1º de anillas huecas.
6º hora. Anatomia. Terminamos el tema, ajustamos los dias de exámenes, viernes.
16 octubre examen tema 1 y 2.
13 noviembre tema 3 y 4
4 diciembre tema 5 y 6.
recuperación tras 10 de diciembre
1º, 2º y 3º hora. Corte de cabello. Teoria libro, hacer fichas. Viernes materiales
4º y 5º hora. Cambio de forma. Muñeca termine la 1º de anillas huecas.
6º hora. Anatomia. Terminamos el tema, ajustamos los dias de exámenes, viernes.
16 octubre examen tema 1 y 2.
13 noviembre tema 3 y 4
4 diciembre tema 5 y 6.
recuperación tras 10 de diciembre
sábado, 3 de octubre de 2009
Dia 2 Octubre 09
Dia 2 de Octubre 09
1º hora AGC, no fui, pero dio tema y ejercicios.
2º hora, Anatomia, dimos el tejido conectivo repasando el epiterial, pag 19 y 20.
3º hora Cosmetologia, Corregimos ejercicios, re explico la teoria ya por fin bien.
4º, 5º y 6º hora, Corte de cabello, lave y seque con secador a cristina.
1º hora AGC, no fui, pero dio tema y ejercicios.
2º hora, Anatomia, dimos el tejido conectivo repasando el epiterial, pag 19 y 20.
3º hora Cosmetologia, Corregimos ejercicios, re explico la teoria ya por fin bien.
4º, 5º y 6º hora, Corte de cabello, lave y seque con secador a cristina.
viernes, 2 de octubre de 2009
Ejercicios Formulación
Ejercicios hechos de Formulación:
O Z=8 = 1s2, 2s2 2p4
P Z=15 = 1s2, 2s2 2p6, 3s2 3p3
H Z=1 = 1s1
Ca Z=20 = 1s2, 2s2 2p6, 3s2 3p6, 4s2
Al Z=13 = 1s2, 2s2 2p6, 3s2 3p1
C Z=6 = 1s2, 2s2 2p2
Li Z=3 = 1s2, 2s1
Na Z=11 = 1s2, 2s2 2p6, 3s1
F Z=9 = 1s2, 2s2 2p5
Cl Z=17 = 1s2, 2s2 2p6, 3s2 3p5
S Z=16 = 1s2, 2s2 2p6, 3s2 3p4
Fe Z= 26 = 1s2, 2s2 2p6, 3s2 3p6, 4s2, 3d6
Si Z= 14 = 1s2, 2s2 2p6, 3s2 3p2
Ne Z= 10 = 1s2, 2s2 2p6
He Z= 2 = 1s2
ArZ= 18 = 1s2, 2s2 2p6, 3s2 3p6
KZ= 19 = 1s2, 2s2 2p6, 3s2 3p6, 4s1
Be Z= 4 = 1s2, 2s2
Mn Z= 25 = 1s2, 2s2 2p6, 3s2 3p6, 4s2, 3d5
PB Z= 82 = 1s2, 2s2 2p6, 3s2 3p6, 4s2, 3d10, 4p6, 5s2, 4d10, 5p6, 6s2, 4f14, 5d10, 6p2
Sn Z= 50 = 1s2, 2s2 2p6, 3s2 3p6, 4s2, 3d10, 4p6, 5s2, 4d10, 5p2
Co Z= 27 = 1s2, 2s2 2p6, 3s2 3p6, 4s2, 3d7
Ni Z= 28 = 1s2, 2s2 2p6, 3s2 3p6, 4s2, 3d8
Ga Z= 31 = 1s2, 2s2 2p6, 3s2 3p6, 4s2, 3d10, 4p1
Ti Z= 22 = 1s2, 2s2 2p6, 3s2 3p6, 4s2, 3d2
Au Z=79 = 1s2, 2s2 2p6, 3s2 3p6, 4s2, 3d10, 4p6, 5s2, 4d10, 5p6, 6s2, 4f14, 5d9
Ag Z= 47 = 1s2, 2s2 2p6, 3s2 3p6, 4s2, 3d10, 4p6, 5s2, 4d9
I Z= 53 = 1s2, 2s2 2p6, 3s2 3p6, 4s2, 3d10, 4p6, 5s2, 4d10, 5p5
Ba Z= 56 = 1s2, 2s2 2p6, 3s2 3p6, 4s2, 3d10, 4p6, 5s2, 4d10, 5p6, 6s2
As Z= 33 = 1s2, 2s2 2p6, 3s2 3p6, 4s2, 3d10, 4p3
Xe Z= 54 = 1s2, 2s2 2p6, 3s2 3p6, 4s2, 3d10, 4p6, 5s2, 4d10, 5p6
Rn Z= 86 = 1s2, 2s2 2p6, 3s2 3p6, 4s2, 3d10, 4p6, 5s2, 4d10, 5p6, 6s2, 4f14, 5d10, 6p6
Sr Z= 38 = 1s2, 2s2 2p6, 3s2 3p6, 4s2, 3d10, 4p6, 5s2
Rb Z= 37 = 1s2, 2s2 2p6, 3s2 3p6, 4s2, 3d10, 4p6, 5s1
Cs Z= 55 = 1s2, 2s2 2p6, 3s2 3p6, 4s2, 3d10, 4p6, 5s2, 4d10, 5p6, 6s1
Br Z= 35 = 1s2, 2s2 2p6, 3s2 3p6, 4s2, 3d10, 4p5
At Z= 85 = 1s2, 2s2 2p6, 3s2 3p6, 4s2, 3d10, 4p6, 5s2, 4d10, 5p6, 6s2, 4f14, 5d10, 6p5
Bromuro de Cesio
BrCs
Ioduro de potasio
IK
Anhidrido de Bromo
Br2O, Br2O3, Br2O5, Br2O7
Anhidrido de yodo
I2O, I2O3, I2O5, I2O7
Anhidrido del carbono
CO, CO2
Acido del Bromo
HBrO, HBrO2, HBrO3, HBrO4
acido del yodo
HIO, HIO2, HIO3, HIO4
acido del cloro
HClO, HClO2, HClO3, HClO4
acido del carbono
H2CO2, H2CO3
acido oxacidos
HNO, HNO2, HNO3
bicarbonato sodico
HCO3Na
anhidrido de nitrogeno
N2O, N2O3, N2O5
sales hidracidas
IK
acido hidracidos
IH, ClNa
O Z=8 = 1s2, 2s2 2p4
P Z=15 = 1s2, 2s2 2p6, 3s2 3p3
H Z=1 = 1s1
Ca Z=20 = 1s2, 2s2 2p6, 3s2 3p6, 4s2
Al Z=13 = 1s2, 2s2 2p6, 3s2 3p1
C Z=6 = 1s2, 2s2 2p2
Li Z=3 = 1s2, 2s1
Na Z=11 = 1s2, 2s2 2p6, 3s1
F Z=9 = 1s2, 2s2 2p5
Cl Z=17 = 1s2, 2s2 2p6, 3s2 3p5
S Z=16 = 1s2, 2s2 2p6, 3s2 3p4
Fe Z= 26 = 1s2, 2s2 2p6, 3s2 3p6, 4s2, 3d6
Si Z= 14 = 1s2, 2s2 2p6, 3s2 3p2
Ne Z= 10 = 1s2, 2s2 2p6
He Z= 2 = 1s2
ArZ= 18 = 1s2, 2s2 2p6, 3s2 3p6
KZ= 19 = 1s2, 2s2 2p6, 3s2 3p6, 4s1
Be Z= 4 = 1s2, 2s2
Mn Z= 25 = 1s2, 2s2 2p6, 3s2 3p6, 4s2, 3d5
PB Z= 82 = 1s2, 2s2 2p6, 3s2 3p6, 4s2, 3d10, 4p6, 5s2, 4d10, 5p6, 6s2, 4f14, 5d10, 6p2
Sn Z= 50 = 1s2, 2s2 2p6, 3s2 3p6, 4s2, 3d10, 4p6, 5s2, 4d10, 5p2
Co Z= 27 = 1s2, 2s2 2p6, 3s2 3p6, 4s2, 3d7
Ni Z= 28 = 1s2, 2s2 2p6, 3s2 3p6, 4s2, 3d8
Ga Z= 31 = 1s2, 2s2 2p6, 3s2 3p6, 4s2, 3d10, 4p1
Ti Z= 22 = 1s2, 2s2 2p6, 3s2 3p6, 4s2, 3d2
Au Z=79 = 1s2, 2s2 2p6, 3s2 3p6, 4s2, 3d10, 4p6, 5s2, 4d10, 5p6, 6s2, 4f14, 5d9
Ag Z= 47 = 1s2, 2s2 2p6, 3s2 3p6, 4s2, 3d10, 4p6, 5s2, 4d9
I Z= 53 = 1s2, 2s2 2p6, 3s2 3p6, 4s2, 3d10, 4p6, 5s2, 4d10, 5p5
Ba Z= 56 = 1s2, 2s2 2p6, 3s2 3p6, 4s2, 3d10, 4p6, 5s2, 4d10, 5p6, 6s2
As Z= 33 = 1s2, 2s2 2p6, 3s2 3p6, 4s2, 3d10, 4p3
Xe Z= 54 = 1s2, 2s2 2p6, 3s2 3p6, 4s2, 3d10, 4p6, 5s2, 4d10, 5p6
Rn Z= 86 = 1s2, 2s2 2p6, 3s2 3p6, 4s2, 3d10, 4p6, 5s2, 4d10, 5p6, 6s2, 4f14, 5d10, 6p6
Sr Z= 38 = 1s2, 2s2 2p6, 3s2 3p6, 4s2, 3d10, 4p6, 5s2
Rb Z= 37 = 1s2, 2s2 2p6, 3s2 3p6, 4s2, 3d10, 4p6, 5s1
Cs Z= 55 = 1s2, 2s2 2p6, 3s2 3p6, 4s2, 3d10, 4p6, 5s2, 4d10, 5p6, 6s1
Br Z= 35 = 1s2, 2s2 2p6, 3s2 3p6, 4s2, 3d10, 4p5
At Z= 85 = 1s2, 2s2 2p6, 3s2 3p6, 4s2, 3d10, 4p6, 5s2, 4d10, 5p6, 6s2, 4f14, 5d10, 6p5
Bromuro de Cesio
BrCs
Ioduro de potasio
IK
Anhidrido de Bromo
Br2O, Br2O3, Br2O5, Br2O7
Anhidrido de yodo
I2O, I2O3, I2O5, I2O7
Anhidrido del carbono
CO, CO2
Acido del Bromo
HBrO, HBrO2, HBrO3, HBrO4
acido del yodo
HIO, HIO2, HIO3, HIO4
acido del cloro
HClO, HClO2, HClO3, HClO4
acido del carbono
H2CO2, H2CO3
acido oxacidos
HNO, HNO2, HNO3
bicarbonato sodico
HCO3Na
anhidrido de nitrogeno
N2O, N2O3, N2O5
sales hidracidas
IK
acido hidracidos
IH, ClNa
Formulación
La base de la formulación es el principio basico del atomo, su composición, sobretodo de electrones que son mas faciles de intercambiar entre elementos químicos.
La tabla periódica, es la tabla donde se ordenan de menor a mayor los elementos según su número atómico, Z, de los cuales se deduce su configuración electrónica, divididos en niveles, los electrones(-) del último nivel indica su valencia, de la cual se indica las posibilidades de desprenderse o adquirir electrones, los electrones siempre han de quedar apareados, y todos los átomos pretenden ser estables redondeando su ultima capa con 8 electrones como los gases nobles o inertes.
El oxigeno (O) es muy electro negativo, intenta adquirir electrones.
Formular por pasos:
Paso 1:
Gracias a la queridisima tabla periódica, obtenemos nombre y posicion o Z.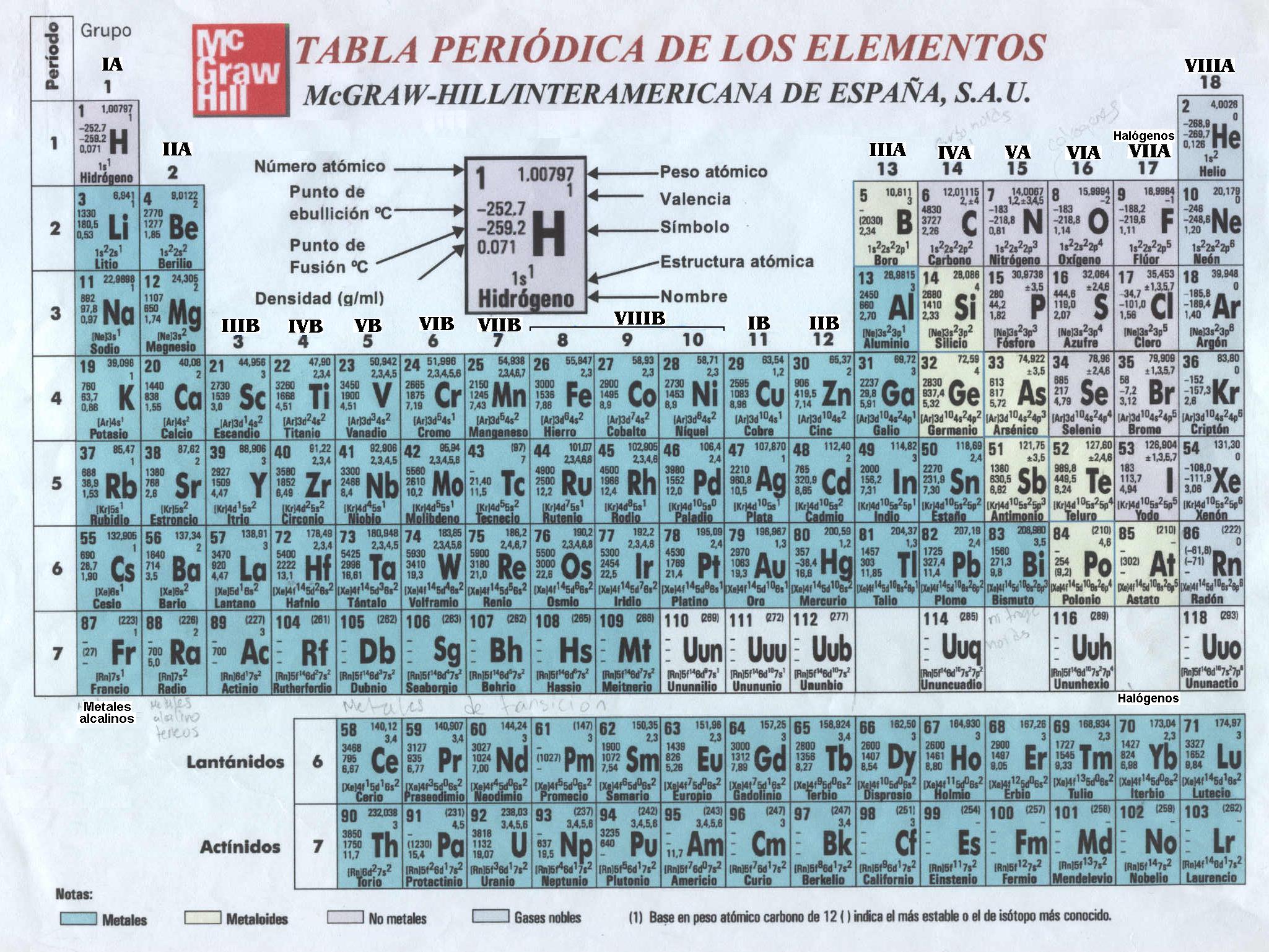
Tomaremos de ejemplo el Yodo (I) como un No Metal
Cuya Z es 53
El Potasio (K) como Metal.
cuyz Z es 19
Y suele aparecer en diferentes enlaces el Oxigeno (O)
Z=16
Y el Hidrógeno (H) Z=1
Paso 2: a partir de Z diseñamos su configuración electrónica.
Recordamos que existen 4 tipos de orbitales s, p, d, f. en el S caben 2 electrones, en el p 6, en el d 10 y en el f 14
 Que nos daran su ultimo nivel de valencia.
Que nos daran su ultimo nivel de valencia.
I Z=53
I= 1s2, 2s2 2p6, 3s2 3p6, 4s2, 3d10, 4p6, 5s2, 4d10, 5p5
---> 1º nivel tiene, 2, 2º nivel, tiene 8, 3º nivel tiene 18, 4º nivel tiene 18, y 5º nivel tiene 7
---> por tanto su valencia es 7, y sus posibilidades de enlaces o valencias que puede actuar dejandolo pares son: 1, 3, 5, y 7 positivizandose al kedarse con mas protones
tiene 7, al compartir su valencia como 1, se quedaria en 6 electrones
al compartir como valencia 3, se quedaria con 4.
como valencia 5, se kedaria con 2.
y con 7, dejaria de tener exceso, volviendose estable inerte con su anterior nivel completo.
K= 1s2, 2s2 2p6, 3s2 3p6, 4s1. Valencia= 1
O= 1s2, 2s2, 2p6, 3s2 3p4. Valencia= 6
H=1s1. Valencia= 1
el Yodo (I) como no metal, puede adquirir electrones de un metal Potasio (K). Sales
I- K+..---->Ioduro potásico
Cargando en este caso el metal positivamente entregarle los electrones al no metal y quedando ambos estables es una union perfecta.
Enlaces tipo covalente, dos no metales enlazados o con hidrógeno (ácidos hídricos).
HI ácido iodhidrico
Enlace covalente, 2 no metales comparten mismos electrones volviendose estables.
la molecula de oxigeno, son 2 átomos de oxigeno, cuya valencia es 6 y comparte de 2 en 2, y propiamente en si le faltarian 2, formando un enlace doble. cada uno comparte 2 permaneciendo con 4, q en total se comparten 4.
::O::O::
H:H
:::I:I:::
Enlaces metálicos, union entre metales. Ejemplo el laton union del 67% cobre y 33% el zinc
Cu Z= 29 Zn Z=30
1s2, 2s2 2p6, 3s2 3p6, 4s2, 3d9 V=2
1s2, 2s2 2p6, 3s2, 4s2, 3d10 V= 1 ó 2
la caracteristicas de los metales e ssu descolocacion electrónica, q sus ultimso electrones forman una nube pro eso son mas conductores. Cu actuaria como 2, y Zn como 1
CuZn2
Paso 3: Formulacion
Oxidos. combinaciones con oxigeno(excepto fluor)
K2O oxido de potasio(Oxidación O + metal)
I2O anhidrido hipoyodoso (Ácido O + no metal= anhidrido)
Hidruros. Combinaciones con Hidrógeno
KH7 Hidruro de Potásio
la combinacion con halógenos y anfígenos se invierte el orden.
y las disoluciones acuosa forman los ácidos hidricos.
HI ácido yodhidrico
Sales binarias Metal +No metal
KI Ioduro potásico
Peróxido. enlaces de doble oxidación O-O
K2O2 peroxido de potasio
Hidróxido. Compuesto metálicos por Oxigeno e Hidrógeno. formando el anion hidroxilo OH-
K(OH) hidróxido potásico o de potasio.
Oxoácidos. H, O + no metal
HIO3 ácido yodico
Oxosales. Sales de oxoácidos sustituyendo el H.
K(IO3) Yodato potasico.
Compuesto cuaternario, Sales ácidas. sustituye 1 de los H
CO + H2O = H2CO2-->I(HCO2)7 bicarbonato peryodico
La nomenclatura, tradicional segun el uso de valencias es :
___Normal______Sales
1---hipo-oso______hipo-ito
2---------oso_________-ito
3---------ico_________-ato
4---Per-ico_______Per-ato
La tabla periódica, es la tabla donde se ordenan de menor a mayor los elementos según su número atómico, Z, de los cuales se deduce su configuración electrónica, divididos en niveles, los electrones(-) del último nivel indica su valencia, de la cual se indica las posibilidades de desprenderse o adquirir electrones, los electrones siempre han de quedar apareados, y todos los átomos pretenden ser estables redondeando su ultima capa con 8 electrones como los gases nobles o inertes.
El oxigeno (O) es muy electro negativo, intenta adquirir electrones.
Formular por pasos:
Paso 1:
Gracias a la queridisima tabla periódica, obtenemos nombre y posicion o Z.

Tomaremos de ejemplo el Yodo (I) como un No Metal
Cuya Z es 53
El Potasio (K) como Metal.
cuyz Z es 19
Y suele aparecer en diferentes enlaces el Oxigeno (O)
Z=16
Y el Hidrógeno (H) Z=1
Paso 2: a partir de Z diseñamos su configuración electrónica.
Recordamos que existen 4 tipos de orbitales s, p, d, f. en el S caben 2 electrones, en el p 6, en el d 10 y en el f 14
 Que nos daran su ultimo nivel de valencia.
Que nos daran su ultimo nivel de valencia.I Z=53
I= 1s2, 2s2 2p6, 3s2 3p6, 4s2, 3d10, 4p6, 5s2, 4d10, 5p5
---> 1º nivel tiene, 2, 2º nivel, tiene 8, 3º nivel tiene 18, 4º nivel tiene 18, y 5º nivel tiene 7
---> por tanto su valencia es 7, y sus posibilidades de enlaces o valencias que puede actuar dejandolo pares son: 1, 3, 5, y 7 positivizandose al kedarse con mas protones
tiene 7, al compartir su valencia como 1, se quedaria en 6 electrones
al compartir como valencia 3, se quedaria con 4.
como valencia 5, se kedaria con 2.
y con 7, dejaria de tener exceso, volviendose estable inerte con su anterior nivel completo.
K= 1s2, 2s2 2p6, 3s2 3p6, 4s1. Valencia= 1
O= 1s2, 2s2, 2p6, 3s2 3p4. Valencia= 6
H=1s1. Valencia= 1
- Diferentes enlaces estables.
el Yodo (I) como no metal, puede adquirir electrones de un metal Potasio (K). Sales
I- K+..---->Ioduro potásico
Cargando en este caso el metal positivamente entregarle los electrones al no metal y quedando ambos estables es una union perfecta.
Enlaces tipo covalente, dos no metales enlazados o con hidrógeno (ácidos hídricos).
HI ácido iodhidrico
Enlace covalente, 2 no metales comparten mismos electrones volviendose estables.
la molecula de oxigeno, son 2 átomos de oxigeno, cuya valencia es 6 y comparte de 2 en 2, y propiamente en si le faltarian 2, formando un enlace doble. cada uno comparte 2 permaneciendo con 4, q en total se comparten 4.
::O::O::
H:H
:::I:I:::
Enlaces metálicos, union entre metales. Ejemplo el laton union del 67% cobre y 33% el zinc
Cu Z= 29 Zn Z=30
1s2, 2s2 2p6, 3s2 3p6, 4s2, 3d9 V=2
1s2, 2s2 2p6, 3s2, 4s2, 3d10 V= 1 ó 2
la caracteristicas de los metales e ssu descolocacion electrónica, q sus ultimso electrones forman una nube pro eso son mas conductores. Cu actuaria como 2, y Zn como 1
CuZn2
Paso 3: Formulacion
Oxidos. combinaciones con oxigeno(excepto fluor)
K2O oxido de potasio(Oxidación O + metal)
I2O anhidrido hipoyodoso (Ácido O + no metal= anhidrido)
Hidruros. Combinaciones con Hidrógeno
KH7 Hidruro de Potásio
la combinacion con halógenos y anfígenos se invierte el orden.
y las disoluciones acuosa forman los ácidos hidricos.
HI ácido yodhidrico
Sales binarias Metal +No metal
KI Ioduro potásico
Peróxido. enlaces de doble oxidación O-O
K2O2 peroxido de potasio
Hidróxido. Compuesto metálicos por Oxigeno e Hidrógeno. formando el anion hidroxilo OH-
K(OH) hidróxido potásico o de potasio.
Oxoácidos. H, O + no metal
HIO3 ácido yodico
Oxosales. Sales de oxoácidos sustituyendo el H.
K(IO3) Yodato potasico.
Compuesto cuaternario, Sales ácidas. sustituye 1 de los H
CO + H2O = H2CO2-->I(HCO2)7 bicarbonato peryodico
La nomenclatura, tradicional segun el uso de valencias es :
___Normal______Sales
1---hipo-oso______hipo-ito
2---------oso_________-ito
3---------ico_________-ato
4---Per-ico_______Per-ato
jueves, 1 de octubre de 2009
Dia 1 Octubre 09
Dia 1 Octubre 09
Resumen:
1º hora, Anatomía hemos dado los tejidos animales y el tejido epitelial pag 17 y 18.
2º y 3º hora, Manicura hemos estado en la biblioteca dando teoría, tema 1, alteraciones patológicas, ha mandado hacer el resumen del tema 1 pag 17, en un folio con forro de plástico.
4º y 5º hora, Cambio de forma el lunes debo entregar la cabeza de anillas huecas o realizarla con la profesora.
6º hora, Higiene hemos dado el 1º tema higiene , limpieza, suciedad, contaminantes, prevención y descontaminación hasta pag 14 , entregar resumen en folio y forro de plástico.
Resumen:
1º hora, Anatomía hemos dado los tejidos animales y el tejido epitelial pag 17 y 18.
2º y 3º hora, Manicura hemos estado en la biblioteca dando teoría, tema 1, alteraciones patológicas, ha mandado hacer el resumen del tema 1 pag 17, en un folio con forro de plástico.
4º y 5º hora, Cambio de forma el lunes debo entregar la cabeza de anillas huecas o realizarla con la profesora.
6º hora, Higiene hemos dado el 1º tema higiene , limpieza, suciedad, contaminantes, prevención y descontaminación hasta pag 14 , entregar resumen en folio y forro de plástico.
Suscribirse a:
Entradas (Atom)



