1º y 2º hora Cosmetología, re explicó, corrigió los anhídridos, se realizaron mas anhídridos y ácidos oxoácidos, y el bicarbonato sódico. Terminaciones hipo-oso, -oso, -ico, Per-ico. Hipo-ito, -ito, -ato, Per-ato.
3º hora,AGC Hicieron cosas sobre el tema pidio las fotocopias resumenes ejercicios etc.
4º, 5º y 6º hora Cambio de forma cabezas, me dio tiempo a terminar las rayas y a realizar varias veces las anillas huecas, sin buenos resultados jejej
miércoles, 30 de septiembre de 2009
Anatomía 28 septiembre 09
Anatomía 28 septiembre 09
Ejercicios:
Ejercicios:
- ¿Qué es una célula?
- Indica cual es la unidad básica que constituye el cuerpo humano. Pon un ejemplo material que presente cierta similitud.
- Realiza un dibujo de una célula indicando cada uno de sus elementos y funciones.
- ¿Qué es la membrana plasmática?¿Cuál es su función?
- Realiza un esquema de los organulos celulares indicando su función principal.
- Indica donde se localiza los siguientes elementos celulares: A) Cromatina, B) Ribosomas, C) Membrana nuclear, D) Nucleolo, E) Citoplasma.
- ¿En qué se diferencia la cromatina de los cromosomas?
- Explica brevemente en que consiste la ingestión, la transformación y excreción de sustancias.
- ¿Por qué es necesario que las células se nutran?
- En la división de la célula ¿Se obtienen células idénticas? Razona la respuesta.
- Explica lo que ocurre en cada fase de la mitosis.
- ¿Es cierto que las células se están dividiendo constantemente?
- Explica las características que diferencian al nucleo celular de una célula en interfase del de una célula en profase.
- Define transporte activo, transporte pasivo, fagocitosis y pinocitosis.
Dia 29 septiembre 09
Hoy han sido todo clases teóricas:
1º hora, AGC, yo convalido pero dio teoria y ejercicios del libro. yo me dedique a copiar cosmetología
2º hora ES, nos organizamos en dobles grupos de los 3 sectores, me toco el 3º sector de servicios. Hicimos un resumen y los expusieron cada grupo.
3º hora HD, fuimos al aula verde, nos indicó el cambio de horarios del miercoles HD pasa a ser AGC y el jueves AGC pasa a ser HD. Ojeamos la fotocopia de higiene y limpieza, cuadros esquemas, diccionario y documentos recuadrados.
4ºy 5º hora Cosmetologia, re explicó, la composicion del átomo y su configuracion. Corrijió las configuraciones mandadas y mandó: anhidridos del Bromo Br y del Yodo I (o+no metal).
6º hora Anatomia se corrijieron los ejercicios quedando 13 y 14 por correjir.
1º hora, AGC, yo convalido pero dio teoria y ejercicios del libro. yo me dedique a copiar cosmetología
2º hora ES, nos organizamos en dobles grupos de los 3 sectores, me toco el 3º sector de servicios. Hicimos un resumen y los expusieron cada grupo.
3º hora HD, fuimos al aula verde, nos indicó el cambio de horarios del miercoles HD pasa a ser AGC y el jueves AGC pasa a ser HD. Ojeamos la fotocopia de higiene y limpieza, cuadros esquemas, diccionario y documentos recuadrados.
4ºy 5º hora Cosmetologia, re explicó, la composicion del átomo y su configuracion. Corrijió las configuraciones mandadas y mandó: anhidridos del Bromo Br y del Yodo I (o+no metal).
6º hora Anatomia se corrijieron los ejercicios quedando 13 y 14 por correjir.
Cosmetología, 17 Septiembre 09
Cosmetología 17 septiembre 09
Esta experiencia aportaba datos que ayudaban a conocer la estructura del átomo y aclaraba algunos errores que se creian que eran ciertos como el modelo atómico de Thomson que consideraba el átomo indivisible.
con estas experiencias se considero un nuevo modelo atómico de Rutherford que decia que en el interior del átomo se encuentra un átomo muy pequeño en relación al átomo por eso la mayor parte del átomo esta vacía. por ese espacio vacío se mueven los electrones(-) mientras que los protones(+) se concentran en el nucleo.
Modelo atómico de Bohr.
Intentando completar el modelo de Rutherford en la mitad del siglo XX(20).
Se continua investigando el movimiento de los electrones alrededor del nucleo y si podian girar a cualquier distancia del nucleo, por eso Bohr establecio un nuevo modelo atómico en el que establecía que la carga negativa de los electrones(-) hacen que sean atraidos por el nucleo que tiene carga positiva. Una forma o modo de vencer esta atracción es estar en constante movimiento, es algo parecido a los planetas que giran alrededor del sol.
Este científico danés llamado Niels Bohr en el siglo XX(20) realizo una serie de estudios en los que dedujo que los electrones(-) giran alrededor del nucleo describiendo solo determinadas órbitas circulares es decir órbitas (energía cuantificada) en las que no se pierden energía por lo que giran y por lo consiguiente no tocan el nucleo.
Asi pues en el átomo los electrones y sus órbitas se organizan en capas y en cada capa hay una cierta energía por lo que se lo llaman nivel de energía.
Por lo tanto el primer electrón estara en el 1º nivel.
Esta experiencia aportaba datos que ayudaban a conocer la estructura del átomo y aclaraba algunos errores que se creian que eran ciertos como el modelo atómico de Thomson que consideraba el átomo indivisible.
con estas experiencias se considero un nuevo modelo atómico de Rutherford que decia que en el interior del átomo se encuentra un átomo muy pequeño en relación al átomo por eso la mayor parte del átomo esta vacía. por ese espacio vacío se mueven los electrones(-) mientras que los protones(+) se concentran en el nucleo.
Modelo atómico de Bohr.
Intentando completar el modelo de Rutherford en la mitad del siglo XX(20).
Se continua investigando el movimiento de los electrones alrededor del nucleo y si podian girar a cualquier distancia del nucleo, por eso Bohr establecio un nuevo modelo atómico en el que establecía que la carga negativa de los electrones(-) hacen que sean atraidos por el nucleo que tiene carga positiva. Una forma o modo de vencer esta atracción es estar en constante movimiento, es algo parecido a los planetas que giran alrededor del sol.
Este científico danés llamado Niels Bohr en el siglo XX(20) realizo una serie de estudios en los que dedujo que los electrones(-) giran alrededor del nucleo describiendo solo determinadas órbitas circulares es decir órbitas (energía cuantificada) en las que no se pierden energía por lo que giran y por lo consiguiente no tocan el nucleo.
Asi pues en el átomo los electrones y sus órbitas se organizan en capas y en cada capa hay una cierta energía por lo que se lo llaman nivel de energía.
- En el 1º nivel de energía de cada átomo solo caben 2 electrones.
- En el 2º nivel de energía de cada átomo solo caben 8 electrones.
- En el 3º nivel de energía de cada átomo caben 16.
- En el 4º nivel caben 32.
- En el 5º nivel caben 64 etc..
Por lo tanto el primer electrón estara en el 1º nivel.
lunes, 28 de septiembre de 2009
Cosmetología 22 septiembre 09
Cosmetología 22 septiembre 09
En este modelo los niveles de energía están cada vez mas alejados del nucleo por lo tanto el 1º nivel es el que esta mas cerca al nucleo y de menor energía.
Para Bohr el átomo esta constituido por el nucleo que tiene la carga positiva y los electrones(-) que se encuentran girando en determinados niveles de energía.
Modelo atómico actual.
El modelo de Bohr no es tampoco preciso para conocer donde se encuentra cada electrón(-) de un átomo. Investigaciones de los espectros de los átomos demostraron que tenían a su vez subniveles. El estudio completo de este tipo de subniveles y del orden de llenado es lo que se conoce como modelo de mecano-cuántico que es el actual.
Las diferencias entre este modelo y el anterior se basa en el primer modelo de Bohr que establece que los electrones se encuentran en órbitas concretas a distancia definida del nucleo, mientras que el módulo mecano-cuántico establece que los electrones(-) se encuentran alrededor del nucleo ocupando posiciones mas o menos probable pero que la posición del electrón no se puede predecir con total exactitud.
Tipos de orbitales atómicos.
Si pudiésemos fotografiar de las posiciones que ocupa el electrón(-) en su movimiento alrededor del nucleo tendríamos una nube de puntos que sería mas densa en la zona donde es mas probable, pues se llama orbital a la región del espacio que rodea al átomo en la que existe una probabilidad elevada de encontrar el electrón(-) y mas ligera en la zona donde es menos probable.
Se llama orbital a la región de espacio que rodea el átomo de la que existe una probabilidad elevada (mayor al 90%) de encontrar electrón.
Tipos de orbitales.
Los tipos de orbitales que se han podido identificar con el átomo se representa con s, p, d, f.
La órbita de un átomo depende del nivel y subnivel de energía que ocupe los electrones en el átomo. Siendo los orbitales "s" de forma esférica (O) , los "p" tienen forma de ocho (8), y los "d" y "f" tienen forma aun mas compleja.
Además el orbital "s" del nivel 2, llamado "2s" es mayor que el orbital "s" del nivel 1 y el "3s" sera mayor que el "2s". Lo mismo sucede si comparamos el "3p" con el "2p".
El tipo de orbitales que hay en cada nivel también está determinado, asi en el nivel 1 solo hay orbital de tipo "s", en el 2º nivel hay 2 tipos de orbitales "s" y "p", en el 3ºnivel hay 3 tipos "s", "p", "d" y en el 4º nivel los 4 tipos "s", "p", "d" y "f".
Distribución de los electrones del átomo.
También se llama configuración electrónica de los átomos.
Es el modo en el que esta distribuido los electrones alrededor del nucleo en un átomo determinado. La configuración electrónica del átomo cumple 1 serie de reglas.
La energía de los orbitales de los átomos.
La energía de los orbitales do coinciden con el orden de los niveles y asi sucede que el nivel "4s" tiene menor energía que el "3d". Todos los orbitales se un mismo tipo que hay en un determinado nivel, tiene igual energía por eso se representa a la misma altura. Si un electrón(-) se coloca en uno de esos orbitales se puede colocar en cualquiera de ellos por que tienen la misma energía.
Subniveles:
Los elementos químicos están ordenados por orden creciente de su nº atómico (Z) y recogidos en una tabla que se denomina Tabla periódica de los elementos químicos, en esta tabla existen 7 periodos, que son 7 filas horizontales, y en 18 grupos que son las columnas verticales. La colocación de un elemento químico en una determinada casilla depende de su configuración electrónica.
Los átomos de la columna o grupo 1 se llaman Metales alcalinos, menos el Hidrógeno (H), lo que significa que tiene un electrón(-) en la última capa, por tanto la configuración electrónica es 1s1.
Los electrones(-) de valencia son los del último nivel, en este caso le sobran +1.
El 2º grupo, el átomo del grupo 2 se llaman Metales alcalino-térreos actúan siempre con valencia 2, su configuración electrónica ns2, deben perder 2 en la última capa para ser igual al noble anterior. Los elementos de los grupos 1 y 2 son metales.
Los elementos de los grupos 3 al 12 se le denomina Metales de transición y entre ellos están algunos de los elementos que se reconocen como metales en su estado natural, Oro, Cobre, Plata, etc.
Los átomos del grupo 18 se denominan Gases nobles y tienen configuración ns2 np6 por lo tanto son gases inertes que no reaccionan ante nada. Son los elementos mas estables de la Tabla periódica.
El grupo 17 se denominan Halógenos y son el Flúor, Cloro, Yodo. Tienen 7 electrones(-) en la última capa, su configuración ns2np5.
Los átomos del grupo 16 se llaman Anfígenos, tienen 6 electrones(-) en el último nivel, su configuración electrónica ns2np4. Tienden a ganar 2 electrones.
En este modelo los niveles de energía están cada vez mas alejados del nucleo por lo tanto el 1º nivel es el que esta mas cerca al nucleo y de menor energía.
Para Bohr el átomo esta constituido por el nucleo que tiene la carga positiva y los electrones(-) que se encuentran girando en determinados niveles de energía.
Modelo atómico actual.
El modelo de Bohr no es tampoco preciso para conocer donde se encuentra cada electrón(-) de un átomo. Investigaciones de los espectros de los átomos demostraron que tenían a su vez subniveles. El estudio completo de este tipo de subniveles y del orden de llenado es lo que se conoce como modelo de mecano-cuántico que es el actual.
Las diferencias entre este modelo y el anterior se basa en el primer modelo de Bohr que establece que los electrones se encuentran en órbitas concretas a distancia definida del nucleo, mientras que el módulo mecano-cuántico establece que los electrones(-) se encuentran alrededor del nucleo ocupando posiciones mas o menos probable pero que la posición del electrón no se puede predecir con total exactitud.
Tipos de orbitales atómicos.
Si pudiésemos fotografiar de las posiciones que ocupa el electrón(-) en su movimiento alrededor del nucleo tendríamos una nube de puntos que sería mas densa en la zona donde es mas probable, pues se llama orbital a la región del espacio que rodea al átomo en la que existe una probabilidad elevada de encontrar el electrón(-) y mas ligera en la zona donde es menos probable.
Se llama orbital a la región de espacio que rodea el átomo de la que existe una probabilidad elevada (mayor al 90%) de encontrar electrón.
Tipos de orbitales.
Los tipos de orbitales que se han podido identificar con el átomo se representa con s, p, d, f.
La órbita de un átomo depende del nivel y subnivel de energía que ocupe los electrones en el átomo. Siendo los orbitales "s" de forma esférica (O) , los "p" tienen forma de ocho (8), y los "d" y "f" tienen forma aun mas compleja.

Además el orbital "s" del nivel 2, llamado "2s" es mayor que el orbital "s" del nivel 1 y el "3s" sera mayor que el "2s". Lo mismo sucede si comparamos el "3p" con el "2p".
El tipo de orbitales que hay en cada nivel también está determinado, asi en el nivel 1 solo hay orbital de tipo "s", en el 2º nivel hay 2 tipos de orbitales "s" y "p", en el 3ºnivel hay 3 tipos "s", "p", "d" y en el 4º nivel los 4 tipos "s", "p", "d" y "f".
Distribución de los electrones del átomo.
También se llama configuración electrónica de los átomos.
Es el modo en el que esta distribuido los electrones alrededor del nucleo en un átomo determinado. La configuración electrónica del átomo cumple 1 serie de reglas.
- En cada orbital solo puede haber un número limitado de electrones(-).
- Los electrones(-) se van colocando en el átomo ocupando siempre el orbital de menor energía que esté vacío.
- Cuando se llenan orbitales de la misma energía, 1º se coloca un electrón(-) en cada uno de los orbitales y cuando todos tienen 1 se coloca en el segundo.
La energía de los orbitales de los átomos.
La energía de los orbitales do coinciden con el orden de los niveles y asi sucede que el nivel "4s" tiene menor energía que el "3d". Todos los orbitales se un mismo tipo que hay en un determinado nivel, tiene igual energía por eso se representa a la misma altura. Si un electrón(-) se coloca en uno de esos orbitales se puede colocar en cualquiera de ellos por que tienen la misma energía.

Subniveles:
- "s" caben 2(e-).
- "p" caben 6(e-).
- "d" caben 10(e-).
- "f" caben 14(e-).
Los elementos químicos están ordenados por orden creciente de su nº atómico (Z) y recogidos en una tabla que se denomina Tabla periódica de los elementos químicos, en esta tabla existen 7 periodos, que son 7 filas horizontales, y en 18 grupos que son las columnas verticales. La colocación de un elemento químico en una determinada casilla depende de su configuración electrónica.
Los átomos de la columna o grupo 1 se llaman Metales alcalinos, menos el Hidrógeno (H), lo que significa que tiene un electrón(-) en la última capa, por tanto la configuración electrónica es 1s1.
Los electrones(-) de valencia son los del último nivel, en este caso le sobran +1.
El 2º grupo, el átomo del grupo 2 se llaman Metales alcalino-térreos actúan siempre con valencia 2, su configuración electrónica ns2, deben perder 2 en la última capa para ser igual al noble anterior. Los elementos de los grupos 1 y 2 son metales.
Los elementos de los grupos 3 al 12 se le denomina Metales de transición y entre ellos están algunos de los elementos que se reconocen como metales en su estado natural, Oro, Cobre, Plata, etc.
Los átomos del grupo 18 se denominan Gases nobles y tienen configuración ns2 np6 por lo tanto son gases inertes que no reaccionan ante nada. Son los elementos mas estables de la Tabla periódica.
El grupo 17 se denominan Halógenos y son el Flúor, Cloro, Yodo. Tienen 7 electrones(-) en la última capa, su configuración ns2np5.
Los átomos del grupo 16 se llaman Anfígenos, tienen 6 electrones(-) en el último nivel, su configuración electrónica ns2np4. Tienden a ganar 2 electrones.
Nuevo estilo
En honor de un chico encantador que llevaba una mochila estampada estilo antigua y una camiseta aun mas del coyote de la Warner bross y del cual no se ni el nombre. Asi se quitan las dificultades de que cada cosa este en su sitio :)
domingo, 27 de septiembre de 2009
Cosmetologia 16 septiembre 09
Cosmetologia 16 septiembre 09
La constitución del átomo.
Los primeros modelos atómicos aun incompleto han sido perfeccionados a lo largod e los años con el paso del tiempo y asi muchos elementos se les dejo el lugar porque se sabia que existian y se fueron rellenando.
Nos daba una idea aprox. de como estaba constituido los átomos.
El átomo e suna estructura con un núcleo muy pequeño en relacion al tamaño total del átomo. en el nucleo se encuentran los protones (+) y los neutrones (no tiene carga, n.) y alrededor de este nucleo se mueven los electrones (-) a una distancia del nucleo que es bastante grande en comparación al tamaño del atomo, por tanto la mayor parte del átomo esta vacia.
También sabemos que en el atomo hay particulas más pequeñas llamadas quarks de las que procede los protones y lso neutrones.
Los atomos se representan por un símbolo (O) letra mayúscula y dos números: el número atómico llamado Z, que representa el numero de protones e indica el numero de alectrones en un atomo neutro, y el número másico A que representa le numero de neutrones (n) y protones (+).
______________________________________________________________
Z= (+) /(-)*neutro
A= (n) + (+)
(n) no tienen carga pero si masa
(+) tiene carga y masa
(-) tiene carga y una masa inapreciable.
______________________________________________________________
En un átomo neutro el numero de protones coincide con el numero de electrones. Por tanto Z también representa el numero de electrones de un átomo neutro.
I= electrones en un atomo no neutro.
Todos los átomos de un elemento quimico tienen siempre el mismo número atómico, mismo Z.
Oxigeno--> mismo Z, mismo numero de protones y electrones en estado neutro.
A partir de los 2 numeros Z y A de un átomo podemos deducir muchos datos del mismo.
K= potasio, z= 39, A= 19..............39
.......................................................19K
Podemos deducir de ello:
Se llama isotopo a los átomos que tiene el mismo número de protones y se diferencian en el número de neutrones tendiendo a soltar los que le sobra, que logran romper materia. Son elementos con actividad radiactiva, producen energía ( por tanto número másico)
Por tanto los isótopos son átomos del mismo elemento químico (átomo) pero con distintas propiedades.
Para nombrarlo se indica el nombre del nombre seguido de su número de masa.
39··········· 41
19 K--->19K } isotopo del 41, potasio 41
Entre el k39 y el k41 el numero de protones es el numero atómico Z=19 mismo.
numero másico A= 39-->41
electrones Z= 19-->19
neutrones 20-->22
k41 radiactivo pero estable en 39 y 41.
Partículas que formas el átomo.
Desde principios del siglo XX(20) se sabia que la materia estaba formada por átomos. Distintas experiencias demostraron que la materia podia ganar o perder cargas electricas por eso se planteo la cuestion de si las cargas eléctricas formaban parte de los átomos. Para poder comprobarlo era necesario estudiar el interior de los átomos, algo que en aquel momento parecía muy dificil poder conseguir, para ello la investigación trató de centrarse en el descubrimiento de las partículas que componen el átomo y asi la teoria de DALTON, que consideraba los átomos como partículas indivisibles, fue superada por experiencias que relacionaron las propiedades eléctricas de la materia con la existencia en el interior de un átomo de otro partícula llamadas electrones, que son las responsables del comportamiento eléctrico.
La teoria de Dalton fue superada por Thomson.
Ya ha finales del siglo XIX(19) 1897 un científico británico llamado THOMSON realizo experiencias en los que conseguía provocar una descarga eléctrica en los átomos cuando los introducía en un tubo con un polo positivo y otro negativo. Asi Thomson descubrió que los átomos de los elementos químicos tenian partículas con carga negativa que llamó electrones y que existian en todos los átomos al menos 1 el Hidrógeno.
Por eso podemos decir que en el interior de todos los átomos hay una o mas partículas cargadas negativamente a las que se les llamo electrones(-).
Poco despues 1909 principios del siglo XX(20) un científico estadounidense llamadao ROBERT MILLIKAN utilizó gotitas de aceite suspendidas en un disolvente y midió su carga. Encontró que estas cargas eran siempre múltiples de una carga elemental, que es la carga del electrón(-).
Como la materia es neutra y los átomos tienen partículas con carga negativa, también tienen que poseer partículas con carga positiva.
Posteriormente en experiencias con otro científico ERNEST RUTHERFORD descubrió el proton(+) y estableció un modelo atómico en que el átomo esta constituido por el mismo número de cargas negativas (en los orbitales) y positivas (en el nucleo). El protón(+) tiene la misma carga que el electrón(-) para contrarrestarla pero de signo contrario. el electron no tiene masa pero tiene una carga eléctrica de 1'6 x 10-27 . La masa del protón(+) es 1840 veces mayor que la del electrón(-).
finalmente en 1931 otro científico JAMES CHADWICK descubrió que los átomos poseian una 3º partícula sin carga pero con masa que llamó neutron(n), parecida a la del proton(+), no idéntica.UMA= Unidades de Masa Atómica
··············Proton·················· Electron·················Neutron
masa....1673x10-27 kgr........9'11x10-31 kgr............1675x10-27 kgr
UMA........ 1U....................... 1/1840U...................1U
carga.........+1...........................-1..............................0
Hoy también conocemos partículas llamadas Quarks particulas que originan y forman protones y neutrones.
Modelo atómico.
Se ha intentado explicar que el átomo no era indivisible comos e suponía de Dalton en el siglo XX(20).
Los científicos diseñaron un modelo atómico en lo que plantearon la estructura del átomo con sus protones, neutrones y electrones. para comprobar estos modelos realizaron experiencias pero los resultados de algunas de ellas debieron ser modificados por estudios posteriores.
1º modelo de thomson.
Según él el átomo debia ser como un gran masa con carga positiva e insertados en ella los electrones. La carga negativa de los electrones compensaba la carga positiva para que el átomo fuera neutro.
Para comprobar si el modelo era cierto Rutherford y sus colaboradores diseñaron una experiencia con una lámina de oro en la que aprovechaban algunos descubrimientos sobre la radiactividad de los átomos que se habian conocido recientemente en esa misma época.
Los rayos alfa.
a finales del siglo XIX(19) un señor llamado BECKEREL descubrió que un mineral que contenía Uranio emitia radiación de una forma espontánea. Al analizarla se descubrió que había 3 radiacciones distintas, una de las cuales eran los rayos alfa que estaban formados por partículas cargadas positivamente con mucha energía. A este fenómeno se le denominó radiactividad. Para ver si estas partículas eran capaces de atravezar una lámina de oro.
Experiencia lámina de oro.
En el interior de un bloque de plomo se hizo una cavidad con una salida al exterior y se coloco en esta cavidad el material radiactivo de rayos alfa (Uranio). Se vio que todos los rayos que no tuviesen la dirección de los rayos de salida eran absorvidos por el plomo. Se lograa asi que a la lámina de oro llegara unos rayos procedentes directamente del material radiactivo.
Para conocer la trayectoria que seguían las partículas alfa tras chocar con la lámina de oro se rodeo esta con una película fotográfica que recogía los resultados de la experiencia.
La constitución del átomo.
Los primeros modelos atómicos aun incompleto han sido perfeccionados a lo largod e los años con el paso del tiempo y asi muchos elementos se les dejo el lugar porque se sabia que existian y se fueron rellenando.
Nos daba una idea aprox. de como estaba constituido los átomos.
El átomo e suna estructura con un núcleo muy pequeño en relacion al tamaño total del átomo. en el nucleo se encuentran los protones (+) y los neutrones (no tiene carga, n.) y alrededor de este nucleo se mueven los electrones (-) a una distancia del nucleo que es bastante grande en comparación al tamaño del atomo, por tanto la mayor parte del átomo esta vacia.
También sabemos que en el atomo hay particulas más pequeñas llamadas quarks de las que procede los protones y lso neutrones.
Los atomos se representan por un símbolo (O) letra mayúscula y dos números: el número atómico llamado Z, que representa el numero de protones e indica el numero de alectrones en un atomo neutro, y el número másico A que representa le numero de neutrones (n) y protones (+).
______________________________________________________________
Z= (+) /(-)*neutro
A= (n) + (+)
(n) no tienen carga pero si masa
(+) tiene carga y masa
(-) tiene carga y una masa inapreciable.
______________________________________________________________
En un átomo neutro el numero de protones coincide con el numero de electrones. Por tanto Z también representa el numero de electrones de un átomo neutro.
I= electrones en un atomo no neutro.
Todos los átomos de un elemento quimico tienen siempre el mismo número atómico, mismo Z.
Oxigeno--> mismo Z, mismo numero de protones y electrones en estado neutro.
A partir de los 2 numeros Z y A de un átomo podemos deducir muchos datos del mismo.
K= potasio, z= 39, A= 19..............39
.......................................................19K
Podemos deducir de ello:
- Su nombre. K, potasio.
- Su número atómico, 19 = protones / electrones.
- Su número másico, 39 = protones + neutrones.
- deduciendo tiene 20 neutrones, 39-19=20.
Se llama isotopo a los átomos que tiene el mismo número de protones y se diferencian en el número de neutrones tendiendo a soltar los que le sobra, que logran romper materia. Son elementos con actividad radiactiva, producen energía ( por tanto número másico)
Por tanto los isótopos son átomos del mismo elemento químico (átomo) pero con distintas propiedades.
Para nombrarlo se indica el nombre del nombre seguido de su número de masa.
39··········· 41
19 K--->19K } isotopo del 41, potasio 41
Entre el k39 y el k41 el numero de protones es el numero atómico Z=19 mismo.
numero másico A= 39-->41
electrones Z= 19-->19
neutrones 20-->22
k41 radiactivo pero estable en 39 y 41.
Partículas que formas el átomo.
Desde principios del siglo XX(20) se sabia que la materia estaba formada por átomos. Distintas experiencias demostraron que la materia podia ganar o perder cargas electricas por eso se planteo la cuestion de si las cargas eléctricas formaban parte de los átomos. Para poder comprobarlo era necesario estudiar el interior de los átomos, algo que en aquel momento parecía muy dificil poder conseguir, para ello la investigación trató de centrarse en el descubrimiento de las partículas que componen el átomo y asi la teoria de DALTON, que consideraba los átomos como partículas indivisibles, fue superada por experiencias que relacionaron las propiedades eléctricas de la materia con la existencia en el interior de un átomo de otro partícula llamadas electrones, que son las responsables del comportamiento eléctrico.
La teoria de Dalton fue superada por Thomson.
Ya ha finales del siglo XIX(19) 1897 un científico británico llamado THOMSON realizo experiencias en los que conseguía provocar una descarga eléctrica en los átomos cuando los introducía en un tubo con un polo positivo y otro negativo. Asi Thomson descubrió que los átomos de los elementos químicos tenian partículas con carga negativa que llamó electrones y que existian en todos los átomos al menos 1 el Hidrógeno.
Por eso podemos decir que en el interior de todos los átomos hay una o mas partículas cargadas negativamente a las que se les llamo electrones(-).
Poco despues 1909 principios del siglo XX(20) un científico estadounidense llamadao ROBERT MILLIKAN utilizó gotitas de aceite suspendidas en un disolvente y midió su carga. Encontró que estas cargas eran siempre múltiples de una carga elemental, que es la carga del electrón(-).
Como la materia es neutra y los átomos tienen partículas con carga negativa, también tienen que poseer partículas con carga positiva.
Posteriormente en experiencias con otro científico ERNEST RUTHERFORD descubrió el proton(+) y estableció un modelo atómico en que el átomo esta constituido por el mismo número de cargas negativas (en los orbitales) y positivas (en el nucleo). El protón(+) tiene la misma carga que el electrón(-) para contrarrestarla pero de signo contrario. el electron no tiene masa pero tiene una carga eléctrica de 1'6 x 10-27 . La masa del protón(+) es 1840 veces mayor que la del electrón(-).
finalmente en 1931 otro científico JAMES CHADWICK descubrió que los átomos poseian una 3º partícula sin carga pero con masa que llamó neutron(n), parecida a la del proton(+), no idéntica.UMA= Unidades de Masa Atómica
··············Proton·················· Electron·················Neutron
masa....1673x10-27 kgr........9'11x10-31 kgr............1675x10-27 kgr
UMA........ 1U....................... 1/1840U...................1U
carga.........+1...........................-1..............................0
Hoy también conocemos partículas llamadas Quarks particulas que originan y forman protones y neutrones.
Modelo atómico.
Se ha intentado explicar que el átomo no era indivisible comos e suponía de Dalton en el siglo XX(20).
Los científicos diseñaron un modelo atómico en lo que plantearon la estructura del átomo con sus protones, neutrones y electrones. para comprobar estos modelos realizaron experiencias pero los resultados de algunas de ellas debieron ser modificados por estudios posteriores.
1º modelo de thomson.
Según él el átomo debia ser como un gran masa con carga positiva e insertados en ella los electrones. La carga negativa de los electrones compensaba la carga positiva para que el átomo fuera neutro.
Para comprobar si el modelo era cierto Rutherford y sus colaboradores diseñaron una experiencia con una lámina de oro en la que aprovechaban algunos descubrimientos sobre la radiactividad de los átomos que se habian conocido recientemente en esa misma época.
Los rayos alfa.
a finales del siglo XIX(19) un señor llamado BECKEREL descubrió que un mineral que contenía Uranio emitia radiación de una forma espontánea. Al analizarla se descubrió que había 3 radiacciones distintas, una de las cuales eran los rayos alfa que estaban formados por partículas cargadas positivamente con mucha energía. A este fenómeno se le denominó radiactividad. Para ver si estas partículas eran capaces de atravezar una lámina de oro.
Experiencia lámina de oro.
En el interior de un bloque de plomo se hizo una cavidad con una salida al exterior y se coloco en esta cavidad el material radiactivo de rayos alfa (Uranio). Se vio que todos los rayos que no tuviesen la dirección de los rayos de salida eran absorvidos por el plomo. Se lograa asi que a la lámina de oro llegara unos rayos procedentes directamente del material radiactivo.
Para conocer la trayectoria que seguían las partículas alfa tras chocar con la lámina de oro se rodeo esta con una película fotográfica que recogía los resultados de la experiencia.
- Que la mayoría atravesaba la lámina sin desviarse ==>|==>
- Una pequeña proporción sufrian tranas atravesarla desvio ==>|<
- Una cada 1000 rebotaban y volvian atras <==>|
Anatomia 25 septiembre 09
Anatomia 25 septiembre 09
Tema 1 libro de anatomia pag 15.
La reproducción celular por mitosis y citocinesis. la mitosis y la citocenesis forman la division celular.
La mitosis se compone de 4 fases:
La reproducción de la celula animal consta de un ciclo: division celular y la inter fase o fase de reposo, en la que se duplica el ADN, y se restablece el volumen celular.
En las celulas sexuales la reproduccion se realiza por meiosis. En el cual se divide el ADN en 23 cromosomas, unificndos ea los otros 23 cromosomas externos del sexo opuesto, componiendo asi los 46, para una unica celula
Tema 1 libro de anatomia pag 15.
La reproducción celular por mitosis y citocinesis. la mitosis y la citocenesis forman la division celular.
La mitosis se compone de 4 fases:
- Profase: rompe la membrana nuclear, la cromatina se ordena formando cromosomas, y los centriolos emigran a los polos de la celula formando el huso acromatico.
- Metafase: los cromosomas s e unen al huso acromatico formando la placa ecuatorial.
- Anafase: los cromosomas se separan por la mitad y son dirigidos por el huso acromatico hacia los polos.
- Telofase: desaparece el huso acromatico y cada mitad de los cromosomas de lso polos es rodeado por la membrana frmando 2 nucleos.
La reproducción de la celula animal consta de un ciclo: division celular y la inter fase o fase de reposo, en la que se duplica el ADN, y se restablece el volumen celular.
En las celulas sexuales la reproduccion se realiza por meiosis. En el cual se divide el ADN en 23 cromosomas, unificndos ea los otros 23 cromosomas externos del sexo opuesto, componiendo asi los 46, para una unica celula
Anatomía 24 septiembre 09
Anatomía 24 septiembre 09
Nucleo
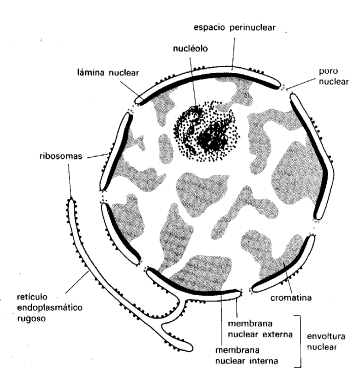
_________________________________________________
La fisiología celular.
La sangre nutre a la célula, al pelo.
Nutrición de la célula.
1. Ingestión de sustancias (sangre)
3. Excreción de los desechos
Nucleo

- Membrana nuclear.
- Poros.
- Carioplasma.
- Nucleoto.
- Cromatina (ADN) = cromosoma (cuando se divide la célula).
- Cromosoma (23 pares, 46).
_________________________________________________
La fisiología celular.
La sangre nutre a la célula, al pelo.
Nutrición de la célula.
1. Ingestión de sustancias (sangre)
- Transporte pasivo.
- Transporte activo (energía).
- Fagocitosis (solidos)
- Pinocitosis (líquidos)
- Digestión (dividir la sustancia)
- Metabolismo:
3. Excreción de los desechos
Anatomía 18 septiembre 09
Anatomía 18 septiembre 09
Componentes de la materia viva.
1. Orgánicos:
Ejemplo: patata, pasta, chocolate.
Ejemplo glúcidos: glucosa, sacarosa, almidón.
Ejemplo: chocolate, bacon, tocino, embutido.
Ejemplo lípidos: colesterol, triglicéridos
Ejemplo= queratina
ARN= copia , traduce.
2. Inorgánicos:
Agua = H2O. Sales minerales (hacen reaccionar a las células).
_________________________________________________________________________________________
Célula --> Tejido { Órgano --> Aparato.
.............................{ Sistema.
celula
¿Que estructura tiene la membrana plasmática?
membrana plasmática
- Citoesqueleto: forma.
- Organulos.
- Centriolos intervienen.
Transforma desechos
Componentes de la materia viva.
1. Orgánicos:
- Glúcidos ( azucares, hidratos de carbono).
Ejemplo: patata, pasta, chocolate.
Ejemplo glúcidos: glucosa, sacarosa, almidón.
- Lípidos (grasa).
Ejemplo: chocolate, bacon, tocino, embutido.
Ejemplo lípidos: colesterol, triglicéridos
- Proteinas (aminoácidos).
Ejemplo= queratina
- Ácidos nucleicos (nucleótidos).
ARN= copia , traduce.
2. Inorgánicos:
Agua = H2O. Sales minerales (hacen reaccionar a las células).
_________________________________________________________________________________________
Célula --> Tejido { Órgano --> Aparato.
.............................{ Sistema.
celula

¿Que estructura tiene la membrana plasmática?
membrana plasmática

- Citoplasma.
- Citoesqueleto: forma.
- Organulos.
- Centriolos intervienen.
- Retículo endoplásmico rugoso.
- Retículo endoplásmico liso.
- Aparato de Golgi.
- Mitocondria (bicapa).
- Ribosomas.
- Vacuolas (monocapa).
- Lisosomas.
Transforma desechos
- Centriolos.
AGC 25 septiembre 09
AGC 25 septiembre 09
Las oportunidades y amenazas (análisis exterior) son siempre aspectos relativos al entorno y su evolución, que condiciona de alguna forma la viabilidad del negocio y actúa en general como tendencia, mareando en cierto modo la marcha de la empresa en el futuro.
Algunos ejemplos pueden ser los siguientes:
Las fortalezas y debilidades (análisis interno) son siempre aspectos relativos a las propias capacidades de los promotores, que condiciona de alguna forma el planteamiento del proyecto y actúan generalmente en el presente.
Algunos ejemplos pueden ser los siguientes:
Las oportunidades y amenazas (análisis exterior) son siempre aspectos relativos al entorno y su evolución, que condiciona de alguna forma la viabilidad del negocio y actúa en general como tendencia, mareando en cierto modo la marcha de la empresa en el futuro.
Algunos ejemplos pueden ser los siguientes:
- A - Aspecto legislativo (regulaciones, homologaciones.)
- B - Aspecto socio-culturales (hábitos de vida, moda.)
- C - Aspecto demográfico (evolución de la pirámide de población, aspectos migratorios.)
- D - Aspectos económicos (renta disponible.)
- E - Aspectos políticos (liberalización del comercio, barreras arancelarias u otro tipo de proteccionismo nacional.)
- F - Aspecto tecnológico (avances técnicos.)
- G - Posibles ventajas de situación o localización (especialización del local, facilidad de acceso a materias primas, proximidad al mercado u otras ventajas en costes.)
Las fortalezas y debilidades (análisis interno) son siempre aspectos relativos a las propias capacidades de los promotores, que condiciona de alguna forma el planteamiento del proyecto y actúan generalmente en el presente.
Algunos ejemplos pueden ser los siguientes:
- A - Conocimiento del negocio, clientes, proveedores.
- B - Conocimiento de algún aspecto técnico.
- C - Capacidad comercial.
- D - Capacidad de generales de gestión.
- E - Capacidad financiera.
Empezando en el fp de peluqueria
Bueno ya que no salio bien lo anterior, ire poniendo los apuntes de peluqueria que generosamente me dejo copiar mi compañera, y todo lo relacionado con el curso
Suscribirse a:
Entradas (Atom)



